Actualmente, la preparación de espermatozoides para fertilización in vitro (FIV) se basa en seleccionar espermatozoides móviles y morfológicamente normales donados por el hombre, pero estas técnicas no garantizan su desarrollo adecuado ya que en realidad adquieren una calidad y funciones óptimas cuando atraviesan un proceso bioquímico clave que ocurre de forma natural en el organismo femenino y es fundamental para la fecundación del óvulo. Para resolver esta problemática, que puede interferir con el éxito de una FIV, especialistas del CONICET desarrollaron HyperSperm, una tecnología que reproduce in vitro lo que sucede al espermatozoide dentro del tracto femenino. Estudios preclínicos y clínicos comprobaron su seguridad y eficacia para mejorar los procedimientos de reproducción asistida. Los resultados del trabajo se publicaron en la revista científica Frontiers in Cell and Developmental Biology.
“Las metodologías convencionales no replican con precisión el entorno dinámico del tracto reproductivo femenino, donde señales bioquímicas e iónicas activan funciones fundamentales en el espermatozoide. En este contexto, HyperSperm representa un avance significativo al recrear esas condiciones in vitro, mejorando potencialmente la calidad funcional de los espermatozoides y, por ende, la eficiencia de los tratamientos de fertilización asistida”, afirma Darío Krapf, investigador del CONICET en el Instituto de Biología Molecular y Celular de Rosario (IBR, CONICET-UNR) y cofundador de Fecundis, una empresa de base tecnológica (EBT) del CONICET que desarrolla tecnologías para aumentar el éxito de los tratamientos diseñados para resolver la infertilidad humana. Y agrega: “Nuestra tecnología, cuya aplicación fue exitosa en estudios preclínicos y clínicos, apunta principalmente a reducir los tiempos en los que una pareja vuelva a su casa con un bebé”.
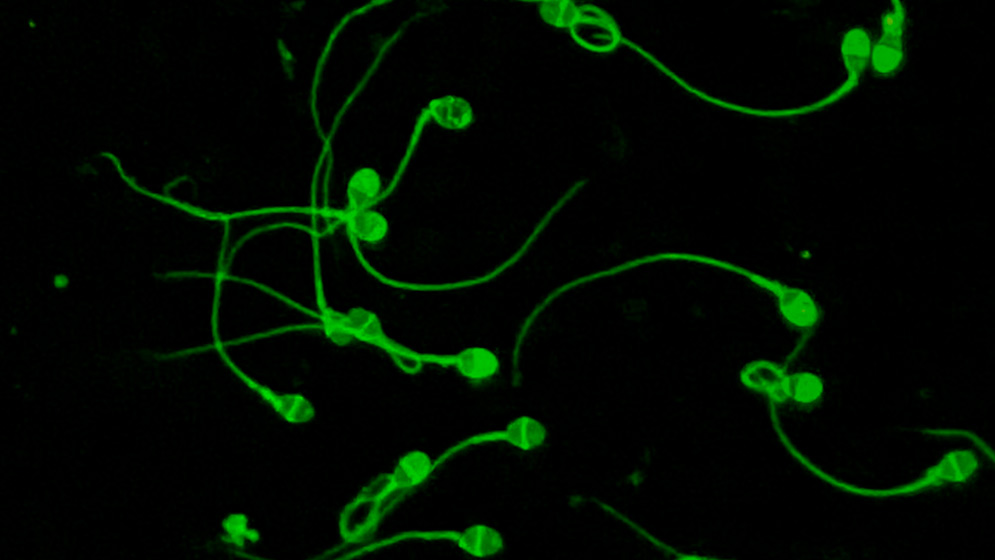
La tecnología HyperSperm fue desarrollada por investigadores del CONICET para mejorar la calidad de los espermatozoides con el fin de aumentar las tasas de éxito de reproducción asistida.
Por su parte, Mariano Buffone, investigador del CONICET en el Instituto de Biología y Medicina Experimental (IBYME, CONICET-Fundación IBYME) y cofundador de Fecundis, agrega: “En nuestro estudio más reciente, compartimos datos preclínicos y clínicos muy alentadores sobre HyperSperm, nuestra innovadora tecnología diseñada para replicar el proceso natural de capacitación del espermatozoide en el tracto reproductivo femenino. Entre estos resultados que nos entusiasman, vemos en estudios preclínicos con ratones, un aumento en la producción de embriones de alta calidad y mejores tasas de implantación después del tratamiento con HyperSperm, cumpliendo estándares de seguridad”. Y continúa: “Pero más importante aún, en nuestro primer ensayo en humanos, incluyendo un diseño dividido en 10 parejas sometidas a FIV con óvulos de donantes, notamos un incremento significativo en el número de blastocistos (embriones aptos para transferencia intra-uterina) utilizables en el grupo tratado con HyperSperm, sin afectar la calidad de los embriones”.
Al momento ha habido tres nacimientos con la tecnología HyperSperm. “Todos en perfecto estado de salud y sin ningún tipo de complicaciones”, destaca Krapf.
Developmental Biology.
“Las metodologías convencionales no replican con precisión el entorno dinámico del tracto reproductivo femenino, donde señales bioquímicas e iónicas activan funciones fundamentales en el espermatozoide. En este contexto, HyperSperm representa un avance significativo al recrear esas condiciones in vitro, mejorando potencialmente la calidad funcional de los espermatozoides y, por ende, la eficiencia de los tratamientos de fertilización asistida”, afirma Darío Krapf, investigador del CONICET en el Instituto de Biología Molecular y Celular de Rosario (IBR, CONICET-UNR) y cofundador de Fecundis, una empresa de base tecnológica (EBT) del CONICET que desarrolla tecnologías para aumentar el éxito de los tratamientos diseñados para resolver la infertilidad humana. Y agrega: “Nuestra tecnología, cuya aplicación fue exitosa en estudios preclínicos y clínicos, apunta principalmente a reducir los tiempos en los que una pareja vuelva a su casa con un bebé”.
Por su parte, Mariano Buffone, investigador del CONICET en el Instituto de Biología y Medicina Experimental (IBYME, CONICET-Fundación IBYME) y cofundador de Fecundis, agrega: “En nuestro estudio más reciente, compartimos datos preclínicos y clínicos muy alentadores sobre HyperSperm, nuestra innovadora tecnología diseñada para replicar el proceso natural de capacitación del espermatozoide en el tracto reproductivo femenino. Entre estos resultados que nos entusiasman, vemos en estudios preclínicos con ratones, un aumento en la producción de embriones de alta calidad y mejores tasas de implantación después del tratamiento con HyperSperm, cumpliendo estándares de seguridad”. Y continúa: “Pero más importante aún, en nuestro primer ensayo en humanos, incluyendo un diseño dividido en 10 parejas sometidas a FIV con óvulos de donantes, notamos un incremento significativo en el número de blastocistos (embriones aptos para transferencia intra-uterina) utilizables en el grupo tratado con HyperSperm, sin afectar la calidad de los embriones”.
Al momento ha habido tres nacimientos con la tecnología HyperSperm. “Todos en perfecto estado de salud y sin ningún tipo de complicaciones”, destaca Krapf.
Factor masculino asociado a la infertilidad
El factor masculino asociado a la infertilidad no ha sido abordado en profundidad durante las últimas décadas. En algunos casos, se debe a una pobre motilidad, en otros a escasa cantidad de espermatozoides, y en muchos casos son diagnosticados como “idiopáticos”, debido a la no comprensión de las causas.
“Es particularmente interesante entender que el espermatozoide humano no está preparado para la fecundación luego de la eyaculación. Este espermatozoide se prepara y adquiere capacidad fértil durante la permanencia en el tracto reproductor femenino, luego de la eyaculación, en un proceso denominado capacitación. Y es aquí donde no se comprenden cabalmente los eventos moleculares vinculados a este fenómeno”, explica Krapf. Y continúa: “Sumado a esto, una muestra espermática obtenida por masturbación, y utilizada para fecundación in vitro, nunca pasa por este proceso de maduración en el tracto reproductor femenino. Por lo tanto, no sólo están los problemas asociados a la calidad espermática, sino también al proceso utilizado para la fecundación in vitro”.
En este contexto, Buffone, Krapf, y colegas realizaron múltiples estudios, publicados en revistas científicas internacionales, para dilucidar vías clave que actuaban durante la capacitación espermática en el tracto reproductivo femenino y decidieron llevar este conocimiento a la clínica reproductiva mediante el desarrollo de HyperSperm. “Con esta tecnología mimetizamos lo que le sucede a un espermatozoide en el tracto reproductor de la mujer, pero en un tubo de ensayo. Esto hace que los embriones, generados con estos espermatozoides y mediante técnicas de reproducción asistida, sean más y mejores, y con mejor pronóstico”, afirma Buffone.
“Los planes a corto y mediano plazo son terminar nuestra segunda prueba piloto ampliando el número de pacientes, y cumplimentar las etapas regulatorias para estar en el mercado para 2026-2027”, concluye Krapf.
Los primeros autores del trabajo son Matías Gómez-Elías, de Fecundis y Guillermina Luque, del IBYME y de Fecundis. Del avance también participaron Rita Vassena, experta en medicina reproductiva y Ceo de Fecundis; Natalia Oscoz-Susino, Olinda Briski, Inés Kásparas, también de Fecundis; Analía Novero, Tomás Steeman y Cintia Stival, del IBR; y Marisa Geller, directora Médica de la clínica de fertilidad In Vitro Buenos Aires, y Mariano Lavolpe, Vanina Julianelli y Martín Attie, también de In Vitro Buenos Aires.
Por Bruno Geller - Área Comunicación CONICET
Referencia bibliográfica:
Gomez Elias, M., Luque, G. M., Oscoz Susinno, N., Novero, A. G., Briski, O., Kasparas, I., ... & Buffone, M. G. INCREASED REPRODUCTIVE OUTCOMES AFTER OPTIMIZED SPERM PREPARATION. Frontiers in Cell and Developmental Biology, 13, 1596421.
https://doi.org/10.3389/fcell.2025.1596421








